SAE报告的标准操作规程
药物临床试验严重不良事件报告标准操作规程
1、本中心SAE报告
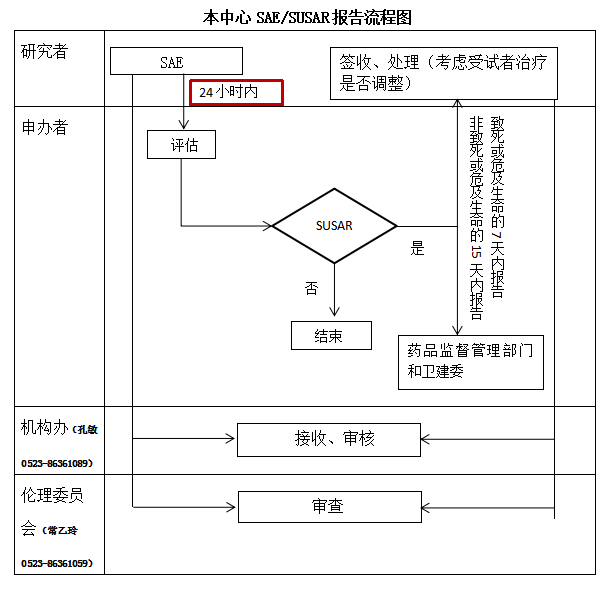
除试验方案或者其他文件(如研究者手册)中规定不需立即报告的严重不良事件外,研究者应当立即(要求在获知后24小时内)向申办者、研究机构(孔敏 0523-86361089)、伦理委员会(常乙玲 0523-86361059)书面报告所有严重不良事件。
严重不良事件报告和随访报告应当注明受试者在临床试验中的鉴认代码,而不是受试者的真实姓名、公民身份号码和住址等身份信息。严重不良事件报告表填写,应保证报告内容完整、准确,以便申办者、研究机构、伦理委员会进行进一步的评估。研究者随后应当及时提供详尽的SAE 随访报告、总结报告(如果适用)。
涉及死亡事件的报告,研究者应当向申办者、研究机构、伦理委员会提供其他所需要的资料,如尸检报告和最终医学报告。
2、本中心SUSAR报告:
研究者收到申办者提供的SUSAR报告后应当及时签收阅读,并考虑受试者的治疗,是否进行相应调整,必要时尽早与受试者沟通。
研究者审阅后签署临床试验机构办和伦理委员会递交信、说明是否需要调整受试者的治疗或修改研究方案,同SUSAR文件一并递交至临床试验机构办和伦理委员会审查。
3、非本中心SUSAR报告
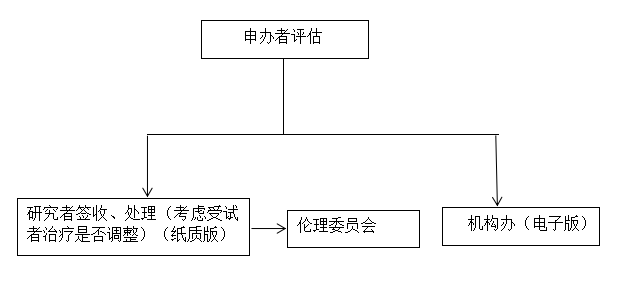
研究者收到申办者提供的临床试验的相关安全性信息后应当及时签收阅读,并考虑受试者的治疗,是否进行相应调整,必要时尽早与受试者沟通,并应当向伦理委员会报告由申办方提供的可疑且非预期严重不良反应。
机构办接收申办者递交的非本中心SUSAR报告的电子版,邮箱13961087102@163.com,邮件命名:合作科室-申办者-药物名称-SUSAR)。
4、药物研发期间安全性更新报告(DSUR)
申办者提供的DSUR应当包括临床试验风险与获益的评估,有关信息通报给所有参加临床试验的研究者、临床试验机构及伦理委员会。报告时限参照ICH-E2F及CDE《研发期间安全性更新报告要求及管理规定》,进行年度报告递交,原则上报告周期不超过一年。纸质版报告递交研究者审阅后,递交伦理委员会审核,机构办进行电子签收,邮箱为13961087102@163.com,邮件命名:合作科室-申办者-药物名称-DSUR。
三、追踪随访
1、如SAE发生转归或距发生之日相隔30日,需填报随访报告或总结报告。
2、如判断与试验用药物相关的SAE,必须随访至该事件出现转归、结束或受试者失访;如判断与试验药物不相关的SAE,必须随访至该事件发生后的第28天;
3、如因妊娠上报SAE的,应随访至胎儿出生或主动终止妊娠,观察有无致畸、致残等事件发生。如方案有特殊规定的,研究者应遵循方案。
四、 安全性事件处理建议
1、申办者在评估事件的严重性和相关性时,如果与研究者持有不同的意见,特别是对研究者的判断有降级的意见(如:将研究者判断为相关的事件判断为不相关),必须写明理由。在相关性判断中不能达成一致时,其中任一方判断不能排除与试验药物相关的,也应快速报告。
2、在撰写评估报告时,申办者需要明确相关性判断的依据。应谨慎地判断相关性,在无确凿依据判断无关时,倾向于判断为有关。
附件:
本中心SAE/SUSAR报告流程图 TZRY-JG-AF/SOP19-001-3.4
非本中心SUSAR报告流程图 TZRY-JG-AF/SOP19-002-3.4
参考文献:
《药物临床试验质量管理规范》,2020,国家药品监督管理局、国家卫生健康委员会
ICH 《E2B(R2)安全性消息处理和个例安全性报告技术规范》,2018, 国家药品监督管理局
编号: TZRY-JG-AF/SOP19-001-3.4
编号: TZRY-JG-AF/SOP19-002-3.4
非本中心SUSAR报告流程图





用户登录
还没有账号?
立即注册